- Science | 清华大学和南京农大揭示植物抗病基因PGIPs作用机制
- 2024年02月28日来源:中华网
提要:在引进新一代质谱平台 Orbitrap™Astral™并同步配置 Orbitrap Exploris 120 质谱仪后,双方进一步深入技术联合开发,携手努力打造为世界领先的创新蛋白质组和代谢组研发中心。加快和深化对拓展蛋白质组学及多组学领域的探究,更好地服务于生命科学和医学健康研究领域,助力精准医学高质量发展!

2024年2月15日,Science在线发表了由清华大学和南京农业大学合作的研究内容“A plant mechanism of hijacking pathogen virulence factors to trigger innate immunity”。本研究表明,植物在响应病原体入侵过程中,参与抑制病毒聚半乳糖醛酸酶活性的基因PvPGIP2与FpPG(聚半乳糖醛酸酶)的相互作用主要包括两个方面:
1.抑制FpPG酶的活性,促进FpPG水解PGA产生更多的长链低聚半乳糖醛酸酯,同时减少短链低聚半乳糖醛酸酯的产生,进一步可以促进PTI的产生;
2.PvPGIP2结合到上FpPG上之后产生一个底物结合位点,其底物结合活性增强,底物偏好改变。基于结构工程可以将最初缺乏FpPG结合活性的推定PGIP转化为有效的FpPG相互作用蛋白。
具体的研究内容如下:
研究背景:
植物细胞壁由纤维素、半纤维素和果胶组成,是抵御病原体侵袭的主要和关键屏障。病原体分泌各种细胞壁降解酶(CWDEs),如聚半乳糖醛酸酶,以解聚细胞壁多糖,并随后破坏细胞壁的完整性。聚半乳糖醛酸酶由各种病原体产生,它们在发病机制中的作用已经得到了很好的证实。病原性和某些植物源性聚半乳糖醛酸酶属于内糖苷水解酶28家族(内聚半乳糖醛酸酶)。这些酶非特异性地水解细胞壁中α-1,4连接的聚半乳糖醛酸(PGAs,果胶的去酯化高半乳糖醛酸)的糖苷键。为了抵消CWDE的酶活性,植物表达了一系列CWDE抑制蛋白,包括PGIPs。此外,植物已经进化出细胞膜上的模式识别受体(PRRs)来识别CWDEs和/或它们释放的细胞壁片段作为损伤相关的分子模式,从而诱导模式触发免疫(PTI)。例如,拟南芥PRRs壁相关激酶(WAKs)识别聚合度为10至15度的长链低聚半乳糖醛酸酯(OG10-15),作为PTI激发子。因此,病原体多半乳糖醛酸酶在破坏植物细胞壁结构以增强毒力和向植物发出信号以触发防御反应方面具有双重作用。
PGIPs是富含亮氨酸重复序列(LRR)蛋白家族的成员,广泛存在于单子叶植物和双子叶植物中。作为多半乳糖醛酸酶的特异性和高亲和力受体,最具特征的PGIP, Phaseolus vulgaris isoform 2 (PvPGIP2),可以识别几种真菌多半乳糖醛酸酶,包括叶根镰刀菌多半乳糖醛酸酶(FpPG)。CWDE抑制蛋白以一种保守的机制结合CWDE的活性位点。PvPGIP2被提出结合活性位点裂缝使FpPG和炭疽菌多半乳糖醛酸酶1 (CluPG1)失活。除了限制聚半乳糖醛酸酶的破坏潜力外,PGIP-PG相互作用还促进了体外和表达PGIP-PG嵌合体的转基因拟南芥中诱导活性低聚半乳糖醛酸酯的积累。炭黑菌多半乳糖醛酸酶1 (ClPG1)的酶活性对于产生烟草防御反应的激发子至关重要。PGIPs在提高抗病性方面的有效性已在多种作物中得到证实,包括小麦和水稻。然而PGIPs的作用机制仍不清楚。
研究结果:
一、PvPGIP2改变FpPG催化的低聚半乳糖醛酸酯长链和短链比例
1.确定PvPGIP2与FpPG之间存在相互作用
为了重建PvPGIP2和FpPG之间的相互作用,作者在昆虫细胞中分别表达了这两种蛋白。凝胶过滤和分析性超离心实验表明,这两个蛋白在pH 5.0下形成了稳定的复合物,分子比为1:1(图1A和B)。等温滴定量热法(ITC)进一步证实了PvPGIP2-FpPG的相互作用,FpPG与PvPGIP2的解离常数(Kd)为15 nM(图1C)。碱性条件(pH 8.0)完全破坏了PvPGIP2FpPG相互作用,这表明PvPGIP2可能在植物免疫应答的早期阶段发挥作用。盐浓度的增加略微降低了它们的结合亲和力。
2.确定PvPGIP2与FpPG之间的相互作用确实会影响PTI的程度
先前描述的高性能阴离子交换色谱脉冲安培检测(HPAEC-PAD)测定用于研究以PGA为底物,在PvPGIP2存在或不存在的情况下,FpPG催化的低聚半乳糖醛酸产物的大小分布。与之前的数据一致,添加PvPGIP2降低了FpPG催化的PGA水解,表现为生成更多的OG>9和更少的OG<9(图1D)。酶学特征数据支持PvPGIP2抑制FpPG酶活性。
OG10-15激活广泛的PTI防御反应,因此作者首先用FpPG测试了PGA消化产物的PTI诱导活性。接种大豆疫霉P6497前,用dH2O、OG10-15、FpPG+PGA或FpPG- PvPGIP2 +PGA处理大豆黄化下胚轴24小时。接种P649748小时后,用FpPG-PvPGIP2+PGA或OG10-15处理的黄化下胚轴没有明显的疾病发展症状。相比之下,用dH2O、PGA或FpPG+PGA预处理的黄化下胚轴可以观察到明显的疾病症状(图1E)。与此一致,FpPG-PvPGIP2+PGA或OG10-15处理的黄化下胚轴中P6497的生物量显著降低(图1F)。FpPGPvPGIP2+PGA或纯OG10-15比FpPG+PGA或单独使用PGA处理中活性氧(ROS)的产生(图1G)和大豆PTI标记基因细胞色素P450 93家族(GmCYP93)的表达(图1G)程度更大。FpPG-PvPGIP2+PGA更强的PTI诱导活性进一步通过分析拟南芥中胼膜沉积(图1I和J)和PTI相关基因WRKY DNA结合蛋白40 (WRKY40)、植物恢复素缺陷3 (PAD3)、钙调蛋白样41 (CML41)和AtPGIP1的表达得到证实(图1K)。
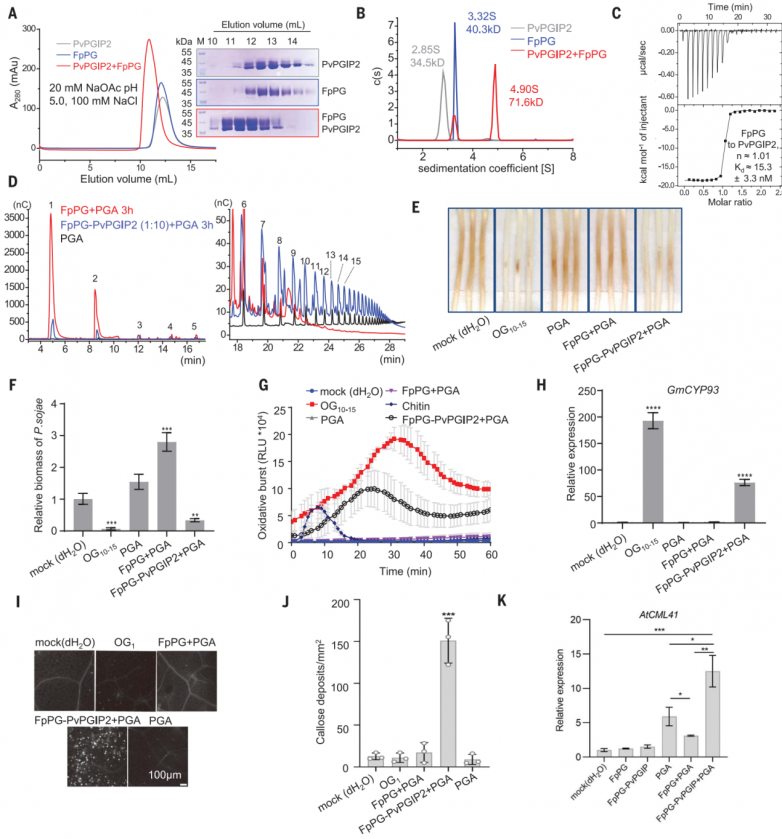
图1.PvPGIP2-FpPG产生诱导活性低聚半乳糖醛酸酯
3.影响PTI程度的主要是短低聚半乳糖醛酸酯
FpPG+PGA混合物含有大量短OGs(图2A),已被证明可以抑制小麦的防御反应。为了测试合成的短低聚半乳糖醛酸酯是否影响植物免疫,作者对OG2-7,OG5-7或OG3对大豆中不同病原体相关分子模式(PAMPs)和OG10-15激活的PTI反应的影响进行测试。OG2-7、OG5-7或OG3预孵育24小时,显著抑制了大豆中flg22、几丁质、疫霉1 (INF1)或OG10-15诱导的氧化爆发产生(图2B)和防御基因GmCYP93、致病相关蛋白2 (GmPR2)和1-氨基环丙烷-1-羧酸合成酶2 (GmACS2)(图2C)的表达。与OG10-15相比,OG2-7、OG5-7或OG3在大豆中没有引发ROS的产生(图2B)。这些结果表明,短的低聚半乳糖醛酸酯可以作为PTI信号传导的一般抑制剂,尽管其潜在机制尚不清楚。FpPGPvPGIP2+PGA混合物也含有短的低聚半乳糖醛酸酯(OG<9),这一观察结果可以解释为什么FpPG-PvPGIP2+PGA引发的免疫反应比OG10-15弱得多(图1,E至H)。

图2.FpPG产生免疫抑制剂低聚半乳糖醛酸酯
二、PvPGIP2N274D-FpPG的整体结构及识别机制
最初试图结晶PvPGIP2-FpPG复合物的努力失败了,可能是因为糖基化会干扰分泌蛋白的结晶。PvPGIP2-FpPG突变复合蛋白的一个预测糖基化位点PvPGIP2 Asn274被Asp取代(PvPGIP2N274D)成功结晶。用分子置换法求解晶体结构,并将其细化为1.93 Å。
晶体中,PvPGIP2N274D与FpPG形成1:1的配合物,埋面为1087.1 Å2(图3A)。FpPG折叠成右侧平行的β螺旋,这是典型的果胶甲基酯酶、水解酶和裂解酶的结构。β螺旋包含10个完整的三股或四股螺旋,它们具有不同的大小和构象,从核心区域伸出。预测的FpPG D191、D212和D213的活性位点残基位于第3圈(T3)环上。PvPGIP2N274D的结构包含10个串联重复的LRRs(图3A),与其他植物中含有LRR的蛋白一样,折叠成右手超螺旋。FpPG结合的PvPGIP2N274D的构象与游离的PvPGIP2几乎相同,这表明与FpPG的相互作用不会引起PvPGIP2N274D的构象变化。1匝(T1)环区和c端侧平行的β链(PB) 2a在很大程度上介导了FpPG与PvPGIP2N274D的N端内表面的相互作用(图3A)。相互作用使PvPGIP2N274D的C端靠近FpPG的β螺旋2至5的长T3环,导致FpPG顶部活性位点关闭,并在PvPGIP2N274D-FpPG复合物中形成活性位点隧道(图3B)。
PB2a垂直包裹在PvPGIP2N274D的N端5条β链上。PvPGIP2N274D的四个芳香残基与FpPG的接触主导了该区域周围的相互作用(图3C)。来自PvPGIP2N274D第一个LRR的Asp56通过与FpPG Asp250和Asn279形成分叉氢键进一步加强了相互作用(图3C)。除了PB2介导的相互作用外,三个T1环进一步促进了PvPGIP2N274D-FpPG相互作用(图3D)。来自β-螺旋9的FpPG Gly314与PvPGIP2 Val152疏水接触,而FpPG的Asn313、Gly343、Ser344和Lys316与PvPGIP2 Tyr105相互作用(图3C)。PvPGIP2 Thr177和Phe201在β-螺旋7/8的T1中心区域进行了组装(图3D)。FpPG的Ala274位于该区域但难以接近(图3D)。在FvPG中,FpPG Ala274突变为体积较大的Thr274,从而消除了PvPGIP2-FpPG相互作用。相反,T274A足以赋予FvPG与PvPGIP2相互作用的能力。Gln224对于PvPGIP2与FpPG的相互作用很重要,它与FpPG Asn304和FpPG Ser272分别在-β螺旋9和β-螺旋8中建立了双齿氢键(图3D)。FpPG Asn304也与PvPGIP2 Phe269形成范德华接触(图3D)。与PvPGIP2相互作用至关重要的FpPG残基在其他PvPGIP2结合的聚半乳糖醛酸酶中大部分是保守的。相比之下,PvPGIP2中关键的FpPG相互作用残基在不同植物的PGIPs中保守性较差,特别是在非豆科植物中。
接下来,作者对PvPGIP2和FpPG进行了氨基酸替换,并使用ITC评估了这些突变对PvPGIP2-FpPG相互作用的影响。Y105E预计会破坏与FpPG残基簇的相互作用(图3C),将PvPGIP2与FpPG结合的结合亲和力降低了900倍。与FpPG T1中心区域相互作用的PvPGIP2 Phe201突变(图3D)类似地损害了PvPGIP2-FpPG相互作用(图3C)。PvPGIP2 V152E破坏了与FpPG β-helix9的相互作用,以Kd ~2.57 mM结合FpPG,效率比野生型PvPGIP2低约170倍。PvPGIP2 β8(图3D)下的FpPG Thr275突变使FpPG与Tyr的PvPGIP2结合亲和力降低了2000多倍。HPAEC-PAD分析表明,这些PvPGIP2-FpPG突变蛋白在水解PGA时产生的低聚半乳糖醛酸谱与单独的FpPG相似。
拟南芥多半乳糖醛酸酶侧根(PGLR)的多半乳糖醛酸酶活性已被证实。PGLR的C端部分,对应于FpPG的PvPGIP2接触表面,被一个额外的C端的α螺旋完全阻断,这在其他一些假定的拟南芥多半乳糖醛酸酶中是保守的。因此,ITC没有发现PGLR和AtPGIP1之间的相互作用。这些数据进一步支持了FpPG C端与PvPGIP2相互作用的相关性。然而单个PGIP可以采用不同的PG抑制机制。
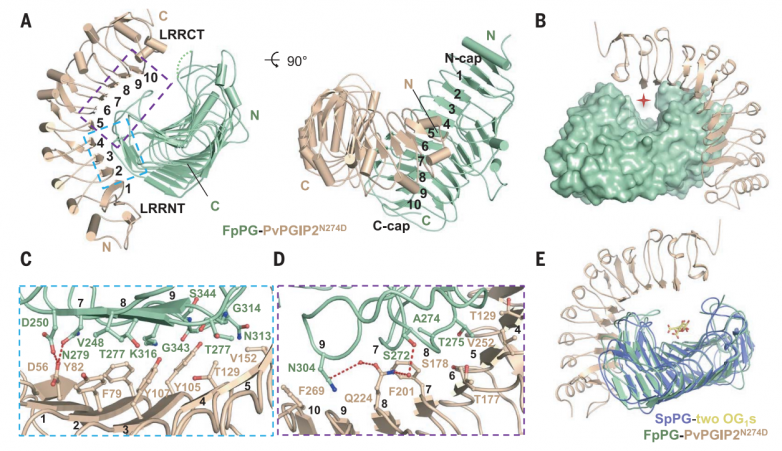
图3.PvPGIP2不阻断FpPG的活性位点
三、PvPGIP2促进免疫活性低聚半乳糖醛酸酯产生的机制
阻断活性位点被认为是PGIP抑制聚半乳糖醛酸酶的机制。然而,PvPGIP2不结合FpPG的活性位点(图3B)。已知PvPGIP1和PvPGIP2具有PGA结合活性。ITC实验表明PGA,而不是其他多糖,在pH 5.0时结合PvPGIP2。PGA的结合活性,在其他物种的PGIPs中是保守的,在pH 8.0时完全被消除,但与Ca2+无关。OG10-15和PvPGIP2之间没有相互作用,可能是因为在PGA中发现的21/31螺旋结构不能在OG10-15中有效形成,但对PvPGIP2识别PGA至关重要。
PGA结合活性表明PvPGIP2与FpPG形成复合物时,可以增强FpPG对底物的结合亲和力。为了量化FpPG和PvPGIP2-FpPG的底物结合亲和力,使用PGA水解能力严重受损的FpPGH234K变体来最大限度地减少底物降解。由于分子量未知,PGA结合FpPGH234K无法通过ITC准确定量。因此选择了市售的OG10-15作为PGA的代理。虽然OG10-15与PvPGIP2之间没有相互作用,但PvPGIP2-FpPGH234K显示出比FpPGH234K (图4A)更高的OG10-15结合亲和力(图4A)。相比之下,低聚半乳糖醛酸酯(OG5-7)与PvPGIP2-FpPGH234K的亲和力要弱得多。正如预期的那样,在相同的条件下,OG5-7和FpPGH234K之间没有相互作用。这些结果表明,酶活性较低的FpPG变体可能更有效地产生较长的低半乳糖醛酸酯。事实上,FpPGH234K或FpPGH234A仍然保留了残余的PGA水解活性,比野生型FpPG产生更多的长链低聚半乳糖醛酸酯(图4B)。FpPGH234K或FpPGH234A催化活性聚半乳糖醛酸酯的产生在大豆(图4C至F)和拟南芥(图4G至I)中得到了证实。与FpPGH234K或FpPGH234A相比,PvPGIP2-FpPGH234K或PvPGIP2-FpPGH234A没有PGA水解活性(图4B)。
FpPGH234K或FpPGH234A催化产物的免疫诱导活性低于PvPGIP2-FpPG降解产物。这一结果表明,除了抑制外,其他机制也可能参与促进PvPGIP2-FpPG产生免疫活性低聚半乳糖醛酸酯。PvPGIP2表面上由Arg183、Arg206、Lys230和Arg252组成的带正电簇是PGA结合所必需的。该簇在不同植物物种的PGIPs中是保守的,但它不参与与FpPG的相互作用(图4J)。该簇位于FpPG-PvPGIP2活性位点通道的连续体中,表明它是底物结合酶复合物活性位点的一部分(图4J)。四残基丙氨酸(PvPGIP24A)同时突变极大地削弱了FpPGH234K-PvPGIP2的OG10 -15结合亲和力(图4A)。相比之下,OG5-7与FpPGH234K-PvPGIP2的结合被完全消除。HPAEC-PAD分析表明,FpPG- PvPGIP24A或FpPGH234K-PvPGIP24A产生的低聚半乳糖醛酸酯的大小分布与FpPG或FpPGH234K催化的低聚半乳糖醛酸酯相似(图4B),这表明PvPGIP2突变消除了对FpPG的抑制作用。综上所述,这些结果表明PvPGIP2在PvPGIP2- FpPG复合物中创建了一个底物结合位点,该位点优先结合OG10-15而不是OG5-7。
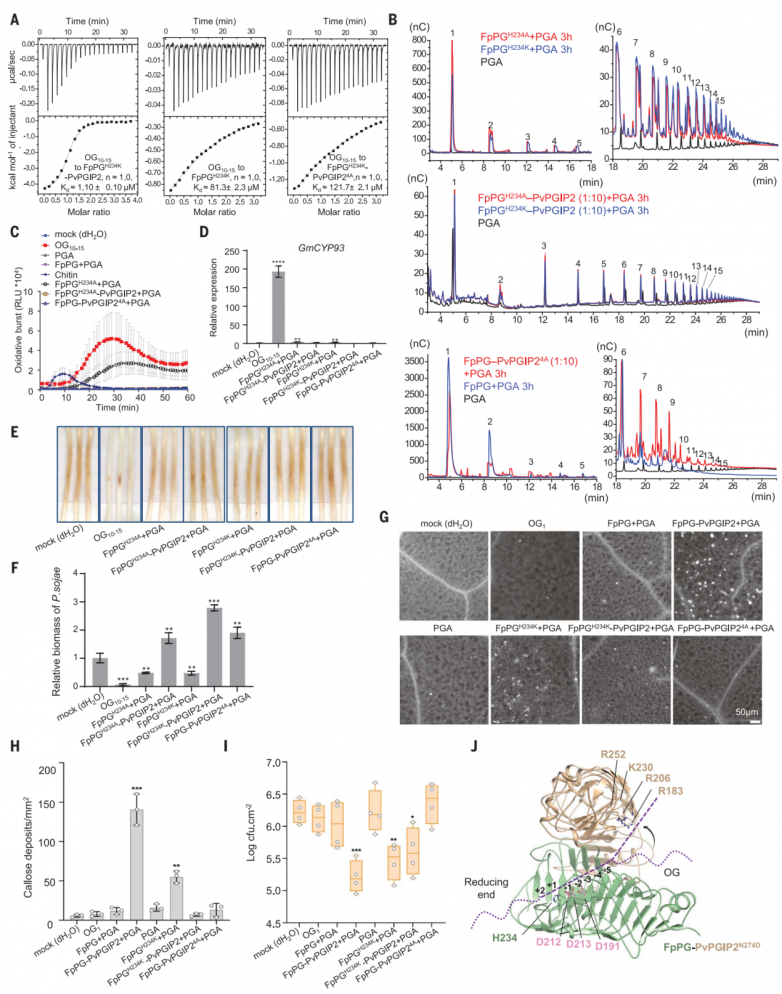
图4.pvpgip2促进免疫活性低聚半乳糖醛酸酯产生的机制
迈维代谢现推出修饰蛋白组方案,翻译后修饰GPS导航,助力您的文章发表,欢迎垂询!


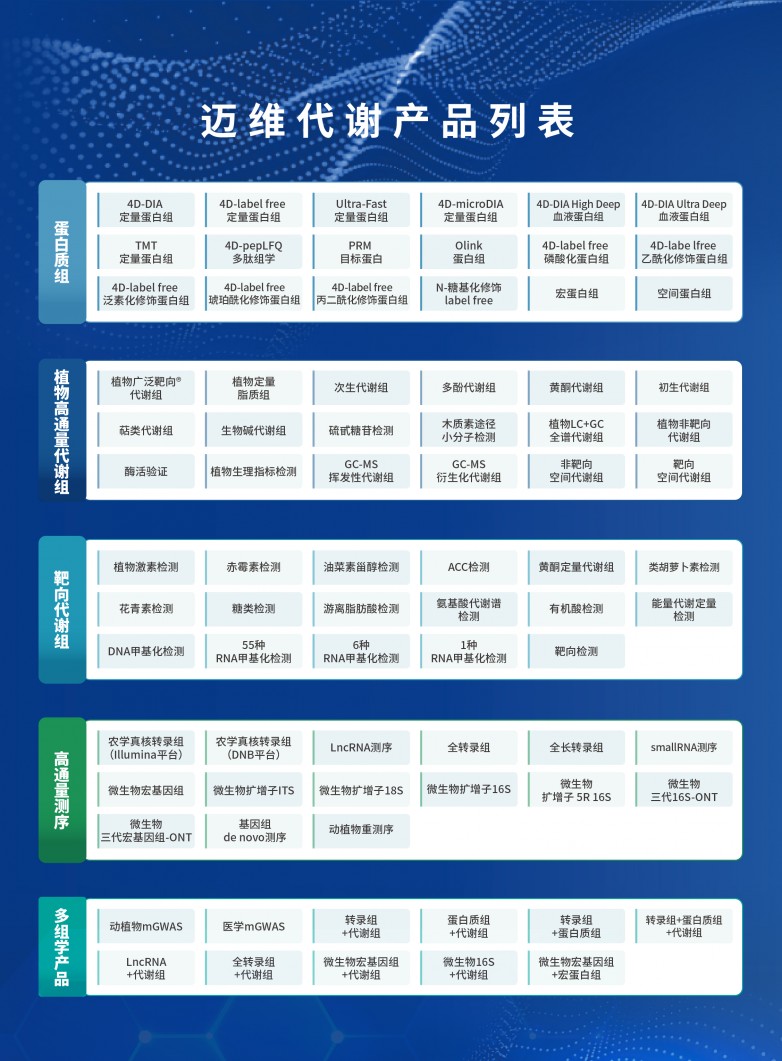
系统生物学研究内容主要包括“基因-蛋白-代谢-表型”等多个层次,越来越多研究表明,多组学已成为生命科学和医学研究的重要工具。“基因组反应了可能发生的变化,蛋白组和代谢组反应了正在或者已经发生的变化”,迈维代谢持续创新质谱技术,创新性的开发出了广泛靶向代谢组检测技术 TM,建立了行业领先的植物代谢数据库和医学代谢物数据库 MWDB,真正实现了“高通量、超灵敏、广覆盖”尽可能多的检测样本中所有的小分子化合物。

与此同时,迈维代谢和赛默飞达成战略合作,详情请点击:拓展组学研究的边界 | 迈维代谢携手赛默飞共建战略合作实验室。在引进新一代质谱平台 Orbitrap™Astral™并同步配置 Orbitrap Exploris 120 质谱仪后,双方进一步深入技术联合开发,携手努力打造为世界领先的创新蛋白质组和代谢组研发中心。加快和深化对拓展蛋白质组学及多组学领域的探究,更好地服务于生命科学和医学健康研究领域,助力精准医学高质量发展!