- 在增长平台和新药的推动下,益普生2024年第一季度实现销售额强劲增长并确认2024年全年指引
- 2024年04月30日来源:南方企业新闻网
提要:"今年是我们增长计划的关键时期,我们将推出四款新药或适应症。我们的重点仍然是产品组合的表现和研发管线的扩张,以及以改善患者生活和医疗结局为中心的明确可持续增长战略。"
全球特药领域生物制药公司益普生(Euronext:IPN;ADR:IPSEY)今日公布了2024年第一季度的销售业绩。
重点回顾
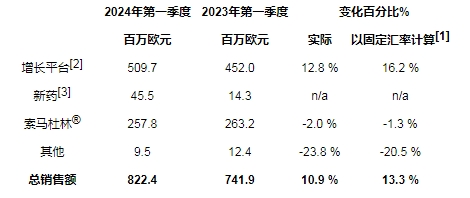
• 以固定汇率计算[1],总销售额增长率为13.3%(报告为10.9%),该增长主要归因于以下两方面:增长平台[2]销售额增长16.2%[1]和新药贡献增加。索马杜林销售额仅下降1.3%[1]
• Onivyde在美国获得监管批准并上市,用于转移性胰腺导管腺癌(mPDAC)的一线治疗
• 确认2024年财务指引
益普生首席执行官David Loew表示:“我们在第一季度实现了出色的业绩,为益普生2024年的增长奠定了坚实的基础。在增长平台的成功和新药贡献增加的支持下,我们的销售额继续保持强劲增长,这证明我们战略计划得到了成功实施。此外,研发管线也不断传来喜报,本季度,Onivyde在美国获得监管批准,用于胰腺癌的一线治疗。”
"今年是我们增长计划的关键时期,我们将推出四款新药或适应症。我们的重点仍然是产品组合的表现和研发管线的扩张,以及以改善患者生活和医疗结局为中心的明确可持续增长战略。"
2024年全年指引
益普生已确认其2024年财务指引,其中排除了任何潜在的额外后期[4]外部创新机会的影响:
• 以固定汇率计算,总销售额增长超过6.0%。基于2024年3月的平均汇率水平,预计汇率将对总销售额产生约1%的不利影响
• 核心营业利润率约为总销售额的30%,包括预期的早期和中期外部创新机会带来的额外研发费用
总销售额指引包括对在美国和欧盟进一步推出索马杜林兰瑞肽仿制药的预期。
业务发展
2024年2月,益普生宣布美国食品药品监督管理局(FDA)已批准Onivyde联合奥沙利铂、氟尿嘧啶和亚叶酸(NALIRIFOX)作为mPDAC成人患者一线治疗的补充新药申请。这是继2015年FDA批准Onivyde联合氟尿嘧啶和亚叶酸用于治疗接受吉西他滨治疗方案后出现疾病进展的mPDAC患者后,第二次批准将Onivyde方案用于治疗mPDAC。在美国批准Onivyde作为mPDAC成人患者的一线治疗药物的同时,Onivyde还被授予孤儿药独占许可,监管独占期持续至2031年(批准后自动启用7年独占期)。
2024年4月,益普生宣布就靶向ROR1肿瘤抗原的抗体偶联药物(ADC)STRO-003达成全球独家许可协议。STRO-003正处于临床前开发的最后阶段。该协议赋予益普生全球独家开发和商业化STRO-003的权利,这也是益普生不断扩大的研发管线中的第一款ADC候选药物。
益普生和Skyhawk Therapeutics于2024年4月宣布签署全球独家合作协议,共同发现和开发调节罕见神经系统疾病RNA的新型小分子药物。该协议包括一项选择权,根据该选择权,益普生将获得在全球范围内开发成功候选药物的独家许可。
Onivyde诉讼
2024年3月,益普生收到关于Conjupro Biotherapeutics, Inc. (Conjupro)向美国FDA提交505(b)(2)申请的第IV段通知函,请求批准盐酸伊立替康脂质体注射液上市,用于治疗既往接受吉西他滨治疗后出现进展的mPDAC患者。该信函对保护Onivyde及其用途的多项专利提出了质疑。作为回应,益普生于2024年4月向美国新泽西州地方法院对Conjupro和某些相关公司实体提起专利侵权诉讼,并将全力捍卫自身权利,因为其专利组合包括将于2027年到期的脂质体组合物的美国专利保护,以及涵盖该制剂和批准用于治疗吉西他滨治疗后出现进展的mPDAC患者的其他专利(有效期至2033年,一线治疗的额外保护有效期至2036年)。
说明
所有财务数据均以百万欧元(€m)为单位。本报告的业绩涵盖2024年3月31日之前的3个月期间(2024年第一季度),而进行数据对比的对象为2023年3月31日之前的3个月期间(2023年第一季度)。
点击【阅读原文】,至益普生全球官网,查阅详细报告。
注
[1]以固定汇率(CER)计算,即通过应用前一时期使用的汇率重新计算相关时期的业绩,排除任何外汇影响
[2]吉适®(A型肉毒毒素)、达必佳®(曲普瑞林)、Cabometyx®(Cabozantinib)和Onivyde®(伊立替康)
[3]Bylvay®(Odevixibat)、Tazverik®(Tazemetostat)和Sohonos®(Palovarotene)
[4]Ⅲ期临床开发或之后
关于益普生
益普生是一家全球性的生物制药公司,专注于在肿瘤、罕见病和神经科学三个治疗领域为患者提供革新型药物。我们的研发管线以外部创新为动力,有近百年的开发经验以及美国、法国、英国的全球中心作为有力的支持。分布于40多个国家的全球团队,共同与我们在世界各地的合作伙伴关系,使我们为100多个国家的患者提供药物。益普生在巴黎(泛欧交易所:IPN)上市并通过赞助的I级美国存托凭证项目(ADR:IPSEY)在美国上市交易。有关益普生的更多信息,请访问ipsen.com.
关于益普生中国
益普生集团于1992年进入中国,2019年在上海设立创新中心,是全球四个研发中心之一。益普生于2021年在上海成立中国区总部,并于2022年根据集团业务变动,同步剥离多元健康业务,专注于特药领域,针对三大疾病领域(肿瘤、罕见病、神经科学)携手上海创新中心持续推出创新治疗方案以满足中国患者亟待解决的治疗需求。
益普生-有关前瞻性声明的警示说明
本文所含前瞻性声明、目的和目标基于集团的管理战略、当前观点和假设。此类声明涉及已知和未知的风险和不确定性,可能导致实际结果、业绩或事件与本文所预期的大不相同。上述所有风险均可能影响集团在未来实现其财务目标的能力,财务目标是基于现今可用信息在合理的宏观经济条件下设定的。"相信"、"期望"和"期待"等词语和类似表述的使用是为了明确前瞻性声明,包括集团对未来事件的期望,此类事件包括监管文件和决定。此外,本文所述目标的制定未考虑外部增长假设和潜在未来收购,而这两者可能会使指标发生变化。目的的依据是集团认为合理的数据和假设。目标取决于将来可能发生的条件或事实,而不仅取决于历史数据。考虑到某些风险和不确定性的发生,实际结果可能与这些指标有很大出入,明显表现为在早期研发阶段或临床试验中有前景的产品可能最终永远不会投放市场或达到其商业目标,尤其是由于注册或竞争原因。集团必须面对或可能面对来自仿制药的竞争,这可能会转化为市场份额的损失。此外,研发过程涉及多个阶段,每个阶段都涉及重大风险,即集团可能无法实现其目的并被迫放弃就自身已投入大量资金的产品所做的努力。因此,集团不能确定在临床前试验中获得的有利结果是否会在随后的临床试验中得到确认,也不能确定临床试验的结果是否足以证明相关产品的安全性和有效性。不能保证产品将获得必要的注册批准或该产品将被证明在商业上是成功的。如果基本假设证明不准确或确实出现风险或不确定性,则实际结果可能与前瞻性声明中的结果有很大不同。其他风险和不确定性包括但不限于一般行业条件和竞争;一般经济因素,包括利率和货币汇率波动;制药行业法规和医疗保健立法的影响;全球医疗成本抑制趋势;竞争对手获得技术进步、新产品和专利;新产品研发中固有的挑战,包括获得监管部门的批准;集团准确预测未来市场状况的能力;生产困难或延误;国际经济的金融不稳定和主权风险;对集团专利的有效性和创新产品的其他保护的依赖;以及可能面临的诉讼,包括专利诉讼和/或监管诉讼。此外,集团依赖第三方来研发和销售某些产品,这些产品可能会产生大额特许权使用费用;这些合作伙伴的行为可能会对集团的活动和财务结果造成损害。集团不能确定其合作伙伴将履行各自的义务。集团可能无法从这些协议中获得任何利益。集团任何合作伙伴违约均会产生低于预期的收益。此类情况可能会对集团的业务、财务状况或业绩产生负面影响。集团明确声明,除非适用法律有所要求,否则其不承担更新或修订本新闻稿中所包含的任何前瞻性声明、目标或假设的任何义务,以反映此类声明所依据的事件、条件、假设或情况的任何变化,也不会就此作出任何承诺。集团的业务受制于其在法国金融市场监管机构备案的注册文件中概述的风险因素。该文件中所列风险和不确定性并非详尽无遗,建议读者参阅集团网站(www.ipsen.com)上集团的最新通用注册文件。