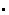- Nat Commun | 海南大学南繁学院罗杰团队发布脂肪酸代谢调控水稻产量重磅成果
- 2024年08月09日来源:中国网
提要:大多数生物的表皮都被角质层覆盖,角质是角质层的主要成分之一,主要由16和18碳的长链羟基脂肪酸组成。脂肪酸代谢产物羟基脂肪酸和羟基单酰基甘油(HMG)占角质单体的30%-60%。角质单体的合成涉及长链酰基辅酶A合成酶(LACS)、细胞色素P450酶(CYP450)和甘油-3磷酸酰基转移酶(GPAT),但反应顺序不确定,可能因物种而异。

文章导读:
大多数生物的表皮都被角质层覆盖,角质是角质层的主要成分之一,主要由16和18碳的长链羟基脂肪酸组成。脂肪酸代谢产物羟基脂肪酸和羟基单酰基甘油(HMG)占角质单体的30%-60%。角质单体的合成涉及长链酰基辅酶A合成酶(LACS)、细胞色素P450酶(CYP450)和甘油-3磷酸酰基转移酶(GPAT),但反应顺序不确定,可能因物种而异。之前的研究中报道了脂肪酸还原酶(OsFAR2)和OsCYP704B2在水稻花药角质生物合成中的作用。角质层除了控制水分流失外,还通过影响器官分化影响花器官的发育,从而影响作物产量。转录因子如AP2、HD-ZIP和MYB已被证明可调节角质层合成。值得注意的是,虽然MADS家族转录因子广泛调控植物花器官发育,但其对角质层的调控仍未被发现。
2024年8月6日,nature communicaitons在线发表了海南大学罗杰教授团队利用重测序、广泛靶向代谢组技术手段,确定了真核脂肪酸和植物初级代谢基因簇(参与合成和运输)通过调节花药育性来控制水稻产量。进一步分析了这一初级代谢基因簇的调控及其进化机制,为禾科作物的生态适应和杂交育种提供依据和遗传资源。

研究摘要:
真核生物基因组中存在种类繁多的代谢基因簇,但脂肪酸代谢基因簇尚未被发现。本研究结合代谢和表型全基因组关联研究,在3号染色体(FGC3)上发现了一个包含6个基因的脂肪酸代谢基因簇的主要位点,该基因簇控制角质单体羟基单酰基甘油(HMGs)的含量和水稻产量,可能是通过FGC3成员转录的变化来实现的。研究发现HMG在内质网中依次由OsFAR2、OsKCS11、OsGPAT6、OsCYP704B2合成,随后由OsABCG22和OsLTPL82转运到外质体。FGC3成员突变导致HMG减少,致使雄性生殖发育缺陷和产量显著下降。OsMADS6和OsMADS17直接调控FGC3,从而影响雄性生殖和产量。FGC3在禾科中是保守的,很可能形成于原禾属植物Pharus latifolius分化之前。所鉴定的真核脂肪酸和植物初级代谢基因簇对禾本科植物的起源和进化有重要影响,在杂交作物育种中具有应用潜力。
部分研究结果:
1.mGWAS和pGWAS共同定位脂肪酸代谢基因簇
为了评估水稻的脂质变异,从全球533种水稻(Oryza sativa)中收集了糙米样本,并使用广泛靶向代谢组学分析策略对脂质代谢物进行了高通量定量分析,共鉴定到267种脂质代谢物。结果表明游离脂肪酸(FFAs)和羟基脂肪酸(HFAs)几乎都在粳稻品种中富集。代谢全基因组关联研究(mGWAS)显示,3号染色体上3.6 Mb的一个主要位点由这些脂肪酸定位(Fig. 1a)。有趣的是,表型全基因组关联研究(pGWAS)揭示了这个位点与水稻单株产量(图1a)和小穗育性共定位。进一步分析揭示了脂肪酸含量与单株产量之间的强相关性(图1b)。结合脂肪酸的代谢途径和该位点的基因注释,鉴定出5个主要候选基因(图1c)。此外在该位点发现了两个注释基因。
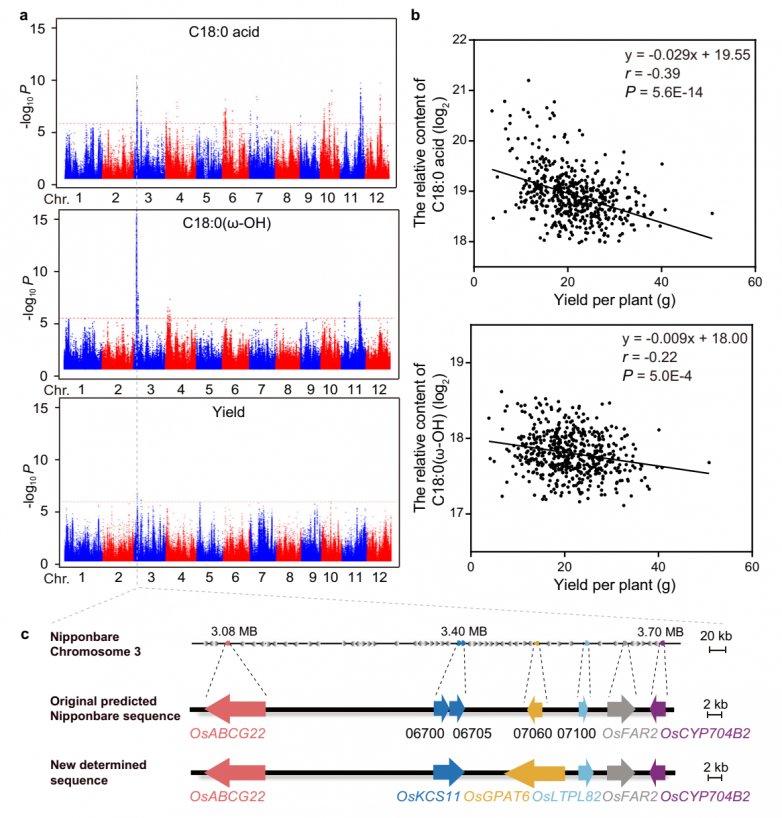
图1.候选基因筛选分析
2.FGC3合成成员功能分析
为了研究这些合成成员(OsFAR2、OsKCS11、OsGPAT6和OsCYP704B2)的代谢作用,对这些候选基因进行了独立克隆。亚细胞定位表明,OsFAR2主要位于质体中,而OsKCS11、OsCYP704B2和OsGPAT6位于内质网,分别显示了它们各自的功能区域。
将OsFAR2重组蛋白在大肠杆菌原核表达系统中表达,并与棕榈酰酰基载体蛋白(C16:0 ACP)孵育,用标准品鉴定其反应产物为棕榈醇(图2a,反应I),当OsFAR2与棕榈酰辅酶a (C16:0 CoA)孵育时,也检测到C16:0醇的产生,但比反应I的速率低(图2a)。以上结果表明,OsFAR2可以在体外催化合成C16:0醇,可用于合成下游代谢反应所需的C16:0。
然后利用酵母表达系统研究了预测的膜定位蛋白OsKCS11、OsCYP704B2和OsGPAT6的体外酶活性。研究结果发现OsKCS11用辅酶A (CoA)激活脂肪酸C16:0,产生C16:0 CoA(经商业标准鉴定;图2b,反应III)。当羟基脂肪酸C16:0(ω-OH)作为底物时,生成的化合物的质量与M /z 1022.3434处的前体离子[M+H]+相对应(图2b,反应IV),通过化学合成的标准物鉴定出16羟棕榈酰基CoA 。这些结果表明OsKCS11可以同时使用脂肪酸和羟基脂肪酸作为底物。进一步实验发现OsCYP704B2对C16:0和C16:0 CoA都有活性,分别生成C16:0(ω-OH) 和C16:0(ω-OH) CoA(图2c,反应V和VI)。最后发现OsGPAT6可以与C16:0 CoA和C16:0(ω-OH) CoA反应,并将一个酰基转移到G3P上,生成2-棕榈酰甘油(MG16: 0,5)和16羟基十六烷酰甘油(HMG16: 0;图2d,反应VII和VIII)。这些结果表明OsKCS11、OsCYP704B2和OsGPAT6催化了连续的代谢反应。当这些蛋白与C16:0孵育时,确实是这样的情况,导致产生C16:0辅酶A作为中间产物,HMG16:0作为终产物(图2e)。这些结果也提示了HMG生物合成的两种可能的合成途径,即OsCYP704B2-OsKCS11OsGPAT6和OsKCS11-OsCYP704B2-OsGPAT6,它们形成了一条发散通路(图2f)。
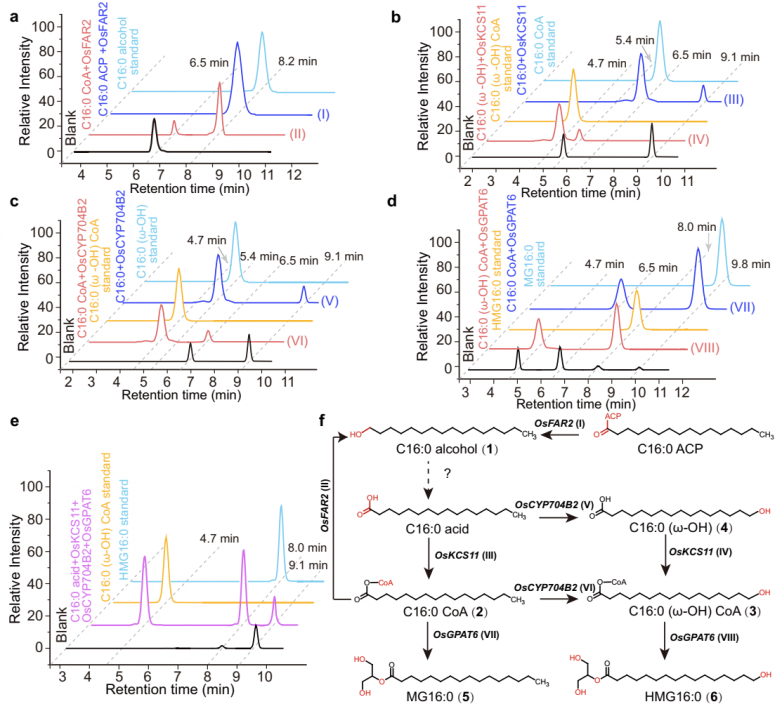
图2.FGC3的功能分析
研究小结:
角质素单体生物合成途径的模型:重新合成和酯化的脂肪酰基ACPs首先被OsFAR2在质体中还原为脂肪醇,然后通过未知基因产生脂肪酸,然后扩散到内质网(ER)。角质素单体HMGs随后可在内质网中通过OsCYP704B2-OsKCS11-OsGPAT6或OsKCS11OsCYP704B2-OsGPAT6两种主要合成途径中的任何一种,通过OsABCG22和OsLTPL82将其转运到细胞壁的外质体表皮,在此沉积角质素。黑色箭头表示本文中验证的步骤,虚线箭头表示未知步骤。
与国内专家们的研究脚步保持一致,我们也步履不停,在2024年上半年我们已经完成了植物广泛靶向®代谢组产品的升级,本次升级主要包括3个方面:
1.数据库升级:本次升级主要增加的为次生代谢物,数据库目前包含35000+物质,其中33000+种均为次生代谢物;
2.检出升级:检出有了显著的提升,目前植物广泛靶向®代谢组的最高检出可以达到4000个物质,Level1平均可以达到600+,最高可到900+;
3.分析升级:MetMapTM的分析已经升级到V2.0版本,包含有60条代谢通路,相较于V1.2版本新增30条通路,通路覆盖黄酮、萜类、生物碱、香豆素等次生物质通路,升级后的MetMap通路为KEGG扩展了2800+种新物质;
4.工具升级:基于迈维云搭建全新的物质功能词典V2.0查询平台,累计超过3500条物质功能信息,为核心功能物质筛选加速;
欢迎老师们咨询~